Dreidimensionales Drucken von patientenindividuellem Knochenersatz
© 2008 Hermann Seitz; Lizenznehmer RTejournal, weitere Informationen sind zu finden unter: http://www.dipp.nrw.de/service/dppl/
urn:nbn:de:0009-2-15357
Zusammenfassung
Moderne generative Fertigungsverfahren ermöglichen die Herstellung dreidimensionaler Modelle, Komponenten und Produkte direkt aus CAD-Daten. Speziell im Bereich der Medizintechnik bietet sich der Einsatz dieser Verfahren zur Herstellung von patientenspezifischen Hilfsmitteln und Medizinprodukten wie Hörgeräten oder Bohrschablonen für die Implantat-Setzung an. Mit Hilfe der 3D-Drucktechnologie lassen sich maßgeschneiderte Knochenimplantate herstellen, die als Stützgerüst für das Tissue Engineering von Knochen eingesetzt werden können.
Das so genannte Rapid Prototyping entwickelte sich vor mehr als 15 Jahren. Dreidimensionale Bauteile werden dabei direkt auf Basis von CAD-Modellen aus formlosem Stoff schichtweise aufgebaut. Zu den bis heute entwickelten und verwendeten hochtechnisierten RP-Verfahren gehören unter anderem das Stereolithografische Verfahren (STL), das (selektive) Lasersintern (SLS), das Laminated Object Manufacturing (LOM), das Fused Deposit Modeling (FDM), das Solid Ground Curing (SGC), das 3D-Printing sowie Multi Jet Modeling [1] . Sämtlichen Verfahren ist der generelle Ansatz des schichtweisen, d. h. generativen Aufbaus von Bauteilen gemeinsam.
Die einzelnen Verfahren unterscheiden sich in der Art der Schichtgenerierung, in dem Material, aus dem das Bauteil gefertigt wird, in der Art der Verbindung der aufeinander folgenden Schichten und darin, wie komfortabel der gesamte Prozess per CAD und Steuerrechner bedient werden kann.
Das Einsatzgebiet der Rapid Prototyping Verfahren hat sich in den letzten Jahren erheblich erweitert. Wurden diese Verfahren ursprünglich zur Herstellung von Anschauungsmodellen und Funktionsprototypen verwendet, so finden sie heute zunehmend Einsatz bei der direkten Herstellung von Einzelstücken und Kleinserien. Für dieses Einsatzgebiet hat sich der Begriff Rapid Manufacturing (RM) etabliert. Die Gesamtheit der Rapid Prototyping und Rapid Manufacturing Verfahren wird heute unter dem Begriff der Generativen Fertigungsverfahren bzw. Rapid Technologien zusammengefasst.
Die Stärken des Rapid Manufacturing kommen insbesondere in der Medizintechnik zum Tragen. Dort wird häufig ein individuelles, auf den Kunden oder Patienten abgestimmtes Produkt verlangt. Die Hörgeräteindustrie hat eine Vorreiterrolle beim Einsatz von Rapid Manufacturing Verfahren zur Herstellung von Ohrpassstücken für Hörgeräte. Mittlerweile wird mehr als 60% der Weltproduktion an Hörgeräteschalen mittels RM-Verfahren hergestellt [2] . So setzten die Firmen Siemens und Phonak das Lasersintern (SLS) und die Firma Widex das Stereolithografische Verfahren (STL) zur Produktion von individuellen Schalen für Im-Ohr-Hörgeräte ein.
Ein weiteres Beispiel für die erfolgreiche Etablierung der RM-Verfahren im Bereich der Medizintechnik stellt die Fertigung von Bohrschablonen für die rechnergestützte Planung von Implantaten dar. Die Firma Materialise Dental (Belgien) stellt diese passgenauen Bohrschablonen auf Grundlage von computertomografischen Aufnahmen des Patienten mit Hilfe des Stereolithografischen Verfahrens her.
Die Einsatzmöglichkeiten der RM-Verfahren zur Einzel- und Kleinserienfertigung von Medizinprodukten gehen über die besprochenen Beispiele weit hinaus. So wird derzeit beispielsweise intensiv an dem Einsatz der RM-Verfahren zur Herstellung von patientenindividuellen Knochenersatzimplantaten gearbeitet.
Um Knochendefekte nach Unfällen oder Tumoroperationen zu überbrücken, gilt immer noch die Verwendung von körpereigenem Knochen als Gold-Standard. Eine andere Möglichkeit der Defektfüllung ist die Verwendung von humanen Spenderknochen, Knochen tierischen Ursprungs oder synthetischen Materialien. Bei humanen oder tierischen Knochen kann jedoch eine Krankheitsübertragung nicht vollständig ausgeschlossen werden. Die Verwendung eigenen Knochengewebes zieht immer die Risiken einer zweiten Operation nach sich.
Daher werden von medizinischer Seite zunehmend synthetische Knochenersatzmaterialien gefordert. Diese sind jedoch bisher nur in Standardformen und -größen erhältlich. Bei größeren Defekten, speziell im Bereich der Mund-Kiefer-Gesichtschirurgie, ist eine individuelle Formgebung der Implantate zur Rekonstruktion der ursprünglichen Funktion und Ästhetik erforderlich.
Aus diesem Grund besteht ein hoher klinischer Bedarf an neuartigen, stabilen, resorbierbaren Scaffolds als Knochenersatz, die aus synthetisch hergestellten Rohstoffen gefertigt werden [3] . Um eine ideale Defektrekonstruktion zu ermöglichen, sollten diese Scaffolds an die Defektstelle des Patienten angepasst sein. Zudem sollen die Scaffolds mit körpereigenen Zellen besiedelt werden und nach Einbringung in einen Knochendefekt als osteokonduktive Leitstruktur dienen. Während das Scaffold langsam abgebaut wird, soll sich an dieser Stelle gleichzeitig neuer Knochen ausbilden.
Im Bereich der Generativen Fertigungsverfahren gewinnen in letzter Zeit in zunehmendem Maße 3D-Druck-Verfahren an Bedeutung, die auf den bekannten Tintendrucktechniken basieren. Dies hat verschiedene Gründe: zum einen lassen sich im 3D-Druck-Verfahren verschiedenste pulverförmige Materialen verarbeiten und somit neue 3D-Druck-Prozesse relativ einfach gestalten, zum anderen sind Tintenschreibwerke gegenüber der bei RP-Verfahren häufig eingesetzten Lasertechnik sehr preiswert.
Beim 3D-Druck-Verfahren handelt es sich um einen pulverbasierten Prozess zur Herstellung von Modellen direkt aus Computerdaten [4] . Dabei werden dünne Schichten eines Pulvers auf eine Grundplatte aufgebracht, die dann durch gezielte Binderzugabe entsprechend des aktuellen Bauteilquerschnitts verfestigt werden. Der Binder wird tröpfchenweise mittels eines Druckkopfs aufgetragen. Das Baumaterial besteht aus dem gebundenen Pulver. Das lose Pulver übernimmt die Stützfunktion und wird nach dem Prozessende entfernt. Bei dem etablierten 3D-Druckprozess zur Herstellung keramischer Implantate [5] resultiert aus dem 3D-Druckverfahren ein Rohling (Grünteil), der in einem weiteren Schritt bei einer Temperatur von ca. 1.250 °C gesintert wird. Dadurch wird eine hohe Endfestigkeit erreicht. Zudem werden bei diesem Schritt die beim 3D-Drucken eingesetzten organischen Binderkomponenten vollständig ausgebrannt.
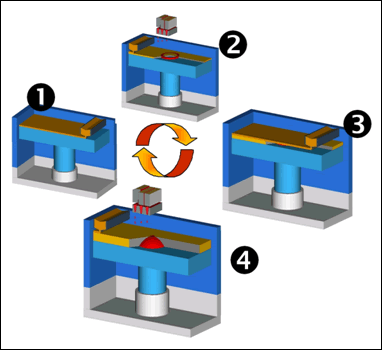
Abb. 1: 3D-Druck-Prozessschema
Als Ausgangsmaterial im 3D-Druckprozess wird derzeit Hydroxylapatit (HA) verwendet, das sich bereits in der plastisch-rekonstruktiven Chirurgie zum Ersatz von Knochenarealen bewährt hat. Hydroxylapatit ist der mineralische Hauptbestandteil des Knochens. Dieser Ausgangsstoff ist bekannt für seine gute Biokompatibilität und besitzt eine hohe Osteokonduktivität. HA-Werkstoffe werden aus boviner Spongiosa oder Korallen durch Pyrolyse und Sinter-Prozesse gewonnen oder synthetisch hergestellt. Für den Einsatz beim 3D-Drucken wird synthetisches HA verwendet, das in Pulver- oder Granulatform vorliegen muss. Um die für den Prozess benötigte Fließfähigkeit zu erhalten, wird das Hydroxylapatit mittels Granulierungsverfahren modifiziert [6] . Als Binderflüssigkeit für das 3D-Drucken kommt eine Polymerlösung zum Einsatz.
Ein wichtiger Aspekt bei der Herstellung patientenindividueller Implantate für das Tissue Engineering von Knochen ist die Generierung des Datensatzes für das herzustellende Implantat (siehe Bild 2). Da speziell bei Schädel-Rekonstruktionen komplexe Formen vorliegen, können keine vordefinierten Standardgeometrien verwendet werden. Deshalb muss hier auf medizinische Patientendaten zurückgegriffen werden. Dazu wird der Schädel des Patienten in einem Computertomographen gescannt. Der resultierende zweidimensionale Datensatz wird mit Hilfe einer speziellen Segmentierungssoftware in ein dreidimensionales Oberflächenmodell umgewandelt. Die einzelnen Objektregionen können durch Auswahl des entsprechenden Schwellwertes für die Segmentierung unterschieden werden.
Nach der Segmentierung der knöchernen Strukturen werden die Daten in ein weiteres Software-Tool mit CAD-Funktionalität eingeladen. Dort kann z.B. durch Spiegelung eines gesunden knöchernen Bereichs auf den entsprechenden Defektbereich und anschließender Subtraktion der beiden Bereiche das zu fertigende Implantat berechnet werden. Zudem eignen sich diese Tools auch zur Konstruktion von Kanalstrukturen im Implantat. Auf Basis des dreidimensionalen Datensatzes kann das Implantat mit Hilfe generativer Fertigungsverfahren hergestellt werden.
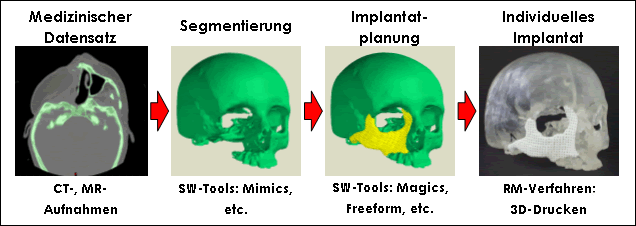
Abb. 2: Datenkette zum Design patientenindividueller Implantate
Anhand verschiedener Testbauteile lässt sich das Potential des 3D-Druckens zur Herstellung von Implantaten charakterisieren. Massive, zylinderförmige Bauteile wurden zur Bestimmung der Druckfestigkeit und des Sinterschrumpfs gefertigt. Die Druckfestigkeit der gesinterten Testgeometrie wurde mit 21,2 ± 2,2 MPa gemessen. Sie liegt damit zwischen den Druckfestigkeitswerten von humaner Spongiosa und kortikalem Knochen [7] . Durch die Einbringung von Kanalstrukturen verringert sich die erreichbare Festigkeit der Implantate. Die hergestellten Konstrukte weisen allerdings genügend mechanische Stabilität auf, um als Scaffold für das Tissue Engineering von Knochen und als Implantat für Knochenersatz zu dienen. Die Konstrukte sind jedoch nicht ausreichend mechanisch stabil, um große Kräfte an stark beanspruchten Stellen des menschlichen Skeletts aufzunehmen. Bei Einsatz der Implantate in stark belasteten Bereichen muss die Stabilität mittels Metallplatten hergestellt werden.

Abb. 3: Testbauteil mit interkonnektierender Kanalstruktur. Die Kanalgeometrien liegen im Bereich von 450 µm.
Um das Einwachsen von Knochenzellen zu erleichtern und die Einheilungszeit der Implantate zu verkürzen, sollten die Implantate interkonnektierende Kanalstrukturen und bestimmte Porositäten aufweisen. Bild 3 zeigt ein Testbauteil mit definierten inneren Kanälen. Die mittels der 3D-Druck-Prozesskette erreichbaren minimalen Kanaldimensionen liegen in einem Bereich von 450 µm. Bei Kanälen mit einem Durchmesser von 565 µm wurde in einer früheren Studie eine gute Knochenintegration festgestellt. Die erreichbare Kanalauflösung beim 3D-Drucken liegt in diesem Bereich und bietet somit die Voraussetzungen für eine gute Knochenintegration [8] .
In Bild 4 ist ein Beispiel eines patientenindividuellen Implantats für einen Defekt im Schädelbereich samt Kunststoff-Schädelmodell zu sehen. Die Außenkontur des Implantats wurde auf Basis medizinischer Daten eines Patienten entworfen. Dazu wurde ein Computertomographie-Datensatz entsprechend der beschriebenen Datenkette aufbereitet und das Implantat mittels 3D-Drucken gefertigt. Das dargestellte Beispiel zeigt sehr gut die Möglichkeiten zur Herstellung individueller, passgenauer Implantate mittels 3D-Drucken auf. Voraussetzung für den Einsatz solcher Implantate im menschlichen Körper ist der Abschluss aller derzeit laufenden und geplanten Voruntersuchungen im Labor und im Tier.

Abb. 4: Beispiel eines patientenindividuellen Implantats für einen Defekt im Schädelbereich samt passendem Kunststoff-Schädelmodell
Für den Einsatz der Scaffolds als Knochenersatzimplantat im menschlichen Körper ist der Nachweis der Biokompatibilität der Scaffolds von entscheidender Bedeutung. Aus diesem Grund wurden entsprechende Versuche (Zytotoxizitätsassay) durchgeführt [9] . Dabei wurde auch das Wachstumsverhalten der Zellen auf den Scaffolds untersucht. Die Ergebnisse zeigen, dass die keramischen Scaffolds keine Toxizität aufweisen, und es konnte eine deutliche Zunahme der Zellen über den Kultivierungszeitraum festgestellt werden. Laufende Untersuchungen beschäftigen sich mit der Differenzierung von menschlichen mesenchymalen Stammzellen in Richtung der osteoblastären Zelllinie. Ein weiterer wichtiger Schritt ist die Etablierung eines geeigneten Tiermodells zur Untersuchung der Knochenheilung von großen Defekten [10] und die entsprechende Untersuchung des Verhaltens der Scaffolds im autologen System.
Die Fertigung von Scaffolds für das Tissue Engineering mittels generativer Fertigungsverfahren bietet ein großes Potential. Die Vielfalt an bekannten generativen Fertigungsverfahren und die breite Auswahl an einsetzbaren Materialien aus dem Bereich Keramik und Polymer bilden dabei die wesentlichen Merkmale. Darüber hinaus gibt es jedoch noch weitere Ansätze zur Optimierung der Prozesskette zur Herstellung von Implantaten. So können durch Aufbringen von spezifischen Peptiden und Wachstumsfaktoren auf die gefertigten Scaffolds und durch biomimetische Oberflächenveränderungen das Differenzierungsverhalten und die Syntheseleistung der aufgebrachten Zellen verbessert werden. Somit können einerseits die Gewebequalität verbessert und andererseits die Kultivierungszeit verkürzt werden.
Diese Bereiche sind speziell im Zusammenhang mit Scaffolds, die mittels generativer Fertigungsverfahren gefertigt wurden, bislang nur unzulänglich untersucht und bilden einen Schwerpunkt zukünftiger Forschungsaktivitäten.
[1] Wohlers T. Wohlers report 2007. Fort Collins, CO: Wohlers Associates, 2007.
[2] Klare M. : Rapid Manufacturing in der Medizintechnik – Neue Verfahrens- und Materialkonzepte. RTejournal - Forum für Rapid Technologie 2007; 4. Ausgabe; http://www.rtejournal.de/ausgabe4/index_html/1117/
[3] Schieker, M.; Seitz, H.; Drosse, I.; Seitz, S.; Mutschler, W.: Biomaterials as Scaffold for Bone Tissue Engineering. European Journal of Trauma 2006; 32:114 – 124.
[4] Sachs, E.; Cima, M.; Williams, P.; Brancazio, D.; Cornie, J.: Three dimensional printing: rapid tooling and prototypes directly from a CAD model. J Eng Ind 1992; 114:481-488.
[5] Seitz, H.; Rieder, W.; Irsen, S.; Leukers, B.; Tille, C.: Three-Dimensional Printing of Porous Ceramic Scaffolds for Bone Tissue Engineering. J Biomed Mater Res 2005; 74B: 782–788.
[6] Irsen, S. H.; Leukers, B.; Höckling, C.; Tille, C.; Seitz, H.: Bioceramic Granulates for use in 3D Printing: Process Engineering Aspects. Materialwissenschaft und Werkstofftechnik 2006; 37:533–537.
[7] An, Y.H.: Mechanical properties of bone. In: An YH, Draughn RA, eds. Mechanical testing of bone and the bone–implant interface. Boca Raton, FL: CRC Press 2000; 41–63.
[8] Gauthier, O.; Bouler, J.-M.; Aguado, E.; Pilet, P.; Daculsi, G.: Macroporous biphasic calcium phosphate ceramics: Influence of macropore diameter and macroporosity percentage on bone ingrowth. Biomaterials 1998; 19:133–139.
[9] Leukers, L.; Gülkan, H.; Irsen, S.; Milz, S.; Tille, C.; Schieker, M.; Seitz, H.: Hydroxyapatite scaffolds for bone tissue engineering made by 3D printing. J Materials Science: Materials in Medicine 2005; 16:1121–1124.
[10] Drosse, I.; Volkmer, E.; Seitz, S.; Seitz, H.; Zahn, K; Penzkofer, R; Matis, U.; Mutschler, W.; Augat, P.; Schieker, M.: Validation of a femoral critical size defect model for orthotopic evaluation of bone healing: A biomechanical, veterinary and trauma surgical perspective. Tissue Engineering Part C: Methods 2008. 14:79-88.
Prof. Dr.-Ing. Hermann Seitz
Lehrstuhl für Fluidtechnik und Mikrofluidtechnik
Universität Rostock
Fakultät für Maschinenbau und Schiffstechnik
Justus-von-Liebig-Weg 6
18059 Rostock
Fon: +49 (0)381 498-9090 (-9091 Sekretariat)
Fax: +49 (0)381 498-9092
Email:
hermann.seitz@uni-rostock.de
WEB:
http://iamserver.fms.uni-rostock.de/